Sinopharm (Peking): BBIBP-CorV
FAAS 1
1 Proov
ChiCTR2000032459
Hiina
2. ETAPP
2 Katseid
NCT04962906
Argentina
ChiCTR2000032459
Hiina
3. ETAPP
6 katseid
NCT04984408
ChiCTR2000034780
Araabia Ühendemiraadid
NCT04612972
Peruu
NCT04510207
Bahrein, Egiptus, Jordaania, Araabia Ühendemiraadid
NCT04560881, BIBP2020003AR
Argentina
NCT04917523
Araabia Ühendemiraadid
Heakskiidud
WHO hädaolukorra kasutamise nimekiri 59 riiki
Angola, Argentina, Bahrein, Bangladesh, Valgevene, Belize, Boliivia (mitme riigi osariik), Brasiilia, Brunei Darussalam, Kambodža, Kamerun, Tšaad, Hiina, Komoorid, Egiptus, Ekvatoriaal -Guinea, Gabon, Gambia, Gruusia, Guyana 、 Iraan (Islamivabariik), Iraak, Jordaania, Kõrgõzstan, Laose Demokraatlik Rahvavabariik
Liibanon, Malaisia, Maldiivid, Mauritaania, auritius, Mongoolia, Montenegro, Maroko, Mosambiik, Namiibia, Nepal, Niger, Põhja -Makedoonia, Pakistan, Paraguay, Peruu, Filipiinid, Kongo Vabariik, Enegal Seleon, Serbia Saared, Somaalia, Sri Lanka, Tai, Trinidad ja Tobago, Tuneesia, Araabia Ühendemiraadid, Venezuela (Boliivia Vabariik), Vietnam, Zimbabwe
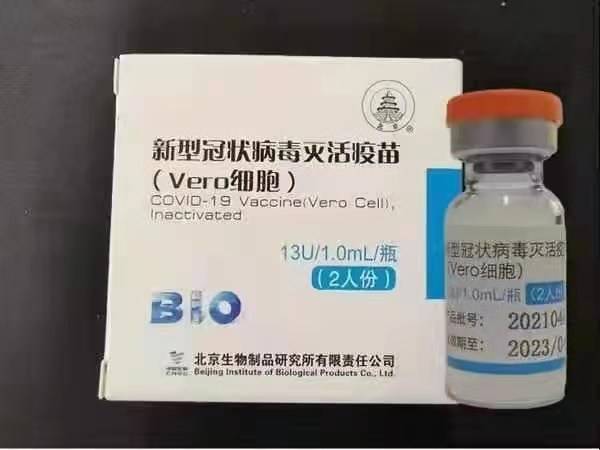
Sinopharm BBIBP-CorV COVID-19 on inaktiveeritud vaktsiin, mis on valmistatud kultuuris kasvatatud viiruseosakestest, millel puudub patogeensus. Selle vaktsiinikandidaadi töötasid välja Sinopharm Holdings ja Pekingi bioloogiliste toodete instituut.
Sinopharm BBIBP-CorV vaktsiin toimib, võimaldades immuunsüsteemil toota antikehi SARS-CoV-2 beeta-koroonaviiruse vastu. Inaktiveeritud viirusevaktsiine, näiteks marutaudi ja A -hepatiidi vaktsiini, on kasutatud aastakümneid. Seda arendustehnoloogiat on edukalt rakendatud paljude tuntud vaktsiinide, näiteks marutaudivaktsiini suhtes.
Sinopharmi SARS-CoV-2 tüvi (WIV04 tüvi ja raamatukogu number MN996528) eraldati patsiendilt Hiinas Wuhani linnas asuvas Jinyintani haiglas. Viirust paljundati kultuuris pädevas Vero rakuliinis ja nakatunud rakkude supernatant inaktiveeriti 48 tunni jooksul β-propiolaktooniga (1: 4000 ruumala, 2 kuni 8 ° C). Pärast rakkude prahi selgitamist ja ultrafiltreerimist viidi läbi teine β-propiolaktooni inaktiveerimine samadel tingimustel nagu esimene inaktiveerimine. WHO andmetel adsorbeeriti vaktsiin 0,5 mg maarjale ja laaditi eeltäidetud süstaldesse 0,5 ml steriilses fosfaatpuhverdatud soolalahuses ilma säilitusaineteta.
31. detsembril 2020 teatas riiklik ravimiamet Sinopharmi väljatöötatud eksperimentaalse vaktsiini heakskiitmisest.
7. mail 2021 teatas Maailma Terviseorganisatsioon vaktsiini heakskiitmisest. WHO hädaolukordade kasutamise loend võimaldas riikidel kiirendada oma regulatiivseid lube COVID-19 vaktsiini importimiseks ja manustamiseks. Samuti on lõpetanud vaktsiini läbivaatamise WHO immuniseerimisstrateegiate nõuanderühm. Kõigi olemasolevate tõendite põhjal soovitab WHO 18 -aastastele ja vanematele täiskasvanutele kahte vaktsiiniannust, mille vahe on 3-4 nädalat. Vaktsiini efektiivsus sümptomaatilise ja haiglahaiguse vastu on hinnanguliselt 79% kõigis vanuserühmades kokku.
Ameerika Meditsiiniliit avaldas 26. mail 2021 "Randomiseeritud kliinilise uuringu: kahe inaktiveeritud SARS-CoV-2 vaktsiini mõju täiskasvanute sümptomaatilisele COVID-19 infektsioonile", järeldades, et "selles randomiseeritud kliinilise uuringu ettemääratud vaheanalüüsis täiskasvanud 2 randomiseeritud kliiniliste uuringute vaheanalüüsis manustatud 2 inaktiveeritud SARS-CoV-2 vaktsiini vähendasid oluliselt sümptomaatilise COVID-19 riski ja tõsiseid kõrvaltoimeid esines harva. " Selles 3. faasi randomiseeritud täiskasvanute uuringus oli kahe inaktiveeritud täisviirusvaktsiini efektiivsus sümptomaatiliste COVID-19 juhtumite korral vastavalt 72,8% ja 78,1%. Kahel vaktsiinil esines haruldasi tõsiseid kõrvaltoimeid, mille esinemissagedus oli sarnane ainult maarjade kontrollrühmaga ja enamik neist ei olnud vaktsineerimisega seotud. Uurimuslik analüüs näitas, et kaks vaktsiini indutseerisid mõõdetavaid neutraliseerivaid antikehi, sarnaselt 1/2 faasi uuringu tulemustele.
WHO SAGE töörühm avaldas 10. mail 2021. aastal ülevaate Sinopharm/BBIBP COVID-19 vaktsiinist. GAVI COVID-19 vaktsiin sisaldab vaktsiiniviaalide monitori, mis annab tervishoiutöötajatele teada, kas vaktsiini on nõuetekohaselt hoitud ja kas sellega ei ole kokku puututud ülekuumenemine. Selle tagajärjel tekkis kahju, teatas GAVI 14. mail 2021. Zebra Technologies toodetud nutikad sildid, mille on valmistanud Temptime Corporation, koosnevad ringist, mille keskel on heledam ruut ja mis on valmistatud värvitu kemikaalist, mis aja jooksul pöördumatult värvi arendab. . See muutub tumedamaks, et anda visuaalset teavet kumulatiivse kuumusega kokkupuute kohta. Kui viaal on olnud kuumuses, mis ületab selle optimaalse hoiuruumi, muutub ruut ringist tumedamaks, mis näitab, et vaktsiini ei tohi enam kasutada.
Narkootikumide BBIBP-CorV COVID-19 vaktsiini ravimikogu raamatukogu registreerimisnumber: DB15807.